Capt_Maloche a écrit :EXPLICATIONS :Les produits de la combustion du fioul sont essentiellement du CO2 et de
la vapeur d'eauRAPPEL:
Réaction de combustion parfaite du G.O. (l'azote n'est pas présent)
2 C16H34 + 49 O2 = 32 CO2 +
34 H2O La re-circulation des gaz brûlés permet :- d'une part la réduction de la température de flamme sous le seuil des 1300°C afin de ne plus produire de NOx
- d'autre part, une augmentation du taux de brassage (mélange) carburant/comburant au coeur de la flamme
- et surtout l'injection de vapeur d'eau issue de la combustion du fioul au coeur de la flamme
Par contre, il est quasiment certain que la tuyère favorise la conversion du monoxyde par la vapeur d'eau. Cette conversion s'effectue en phase gazeuse selon l'équation réversible
CO + H2O <> CO2 + H2
Nous avons sans doute aussi production de "gaz à l'eau" qui est un gaz de synthèse produit par action de l'eau sur du charbon (carbone) ou du coke incandescents. La réaction est la suivante : H2O + C = H2 + CO
On peut aussi se poser la question suivante:
La vapeur d'eau commence sa dissociation thermique (thermolyse de l'eau) à partir de 800°C: 2H²O + Energie = 2H² + O²
La température de la flamme n'est pas homogène, plus chaude au centre et de plus en plus "froide" vers l'extérieur, la température "moyenne mesurée" sur le montage est de 1000°C avec un maximum estimé à 1600°C au centre (flamme jaune, d'où les quelques ppm de NOx mesurés) et un minimum sous les 900°C en couche limite (d'où les quelques ppm de CO mesurés)
La thermolyse de l'eau au coeur de la flamme (dissociation et combustion) a un bilan énergétique nul dans le foyer, mais la combustion "détonnante" de l'hydrogène permet la vaporisation complète des gouttelettes de fioul en suspension dans la flamme (origine des C.O.V. imbrûlés), surtout en périphérie,
là où le montage permet une re circulation maximum,
là où les imbrûlés sont traditionnellement produits sur les flammes de brûleur fioul traditionnels
Sur le CO:
CO:Ce gaz ici indésirable résulte de la combustion de matière carbonée dans des conditions
spécifiques de combustion incomplète. L'oxygénation du foyer reste insuffisante pour brûler
complètement les gaz formés à partir de la matière, mais la réaction est assez exothermique
pour élever et maintenir la température au delà de 950°C. Le monoxyde de carbone se forme
alors préférentiellement au dioxyde de carbone, selon l'équilibre de Boudouard.
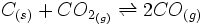
La variation d'enthalpie standard de cette réaction à 298 K vaut Delta r H° = 172,3 kJ.mol-1
Cette réaction est endothermique, elle est donc favorisée par une augmentation de la
température
sa métastabilité en dessous de 950 °C