Les propriétés de l’eau : isotopes et structure moléculaire.
Les propriétés de l’eau 1 : généralités
Les propriétés de l’eau 2 : propriétés physiques et chimiques
Composition isotopique de l’eau
L’eau est un mélange de diverses combinaisons d’isotopes de l’oxygène et de l’hydrogène différant les uns des autres par le nombre de neutrons associés aux protons dans le noyau.
1H,2 H (Deutérium)3H (Tritium)
16O, 17O,18O.
Les rapports isotopiques sont les suivants:
Pour l’hydrogène:
2H/1H=1/6900
3H/1H=1/10 18
Le Tritium est un élément instable, sa période (demi-vie) est de 12,5 ans.
Pour l’oxygène:
18O/16O=1/500
17O/16O=1/2500
Les 4 principales espèces moléculaires et leur fréquences sont les suivantes:
1H216O=99,7 %
1H2 18 O=0,2 %
1H217O = 0,04 %
1HD16O = 0,03 %
D216O = trés faible
Les différents isotopes induisent des différences dans les propriétés physiques des molécules, en particulier leur masse volumique, mais les propriétés chimiques restent les mêmes.
L’eau lourde D2O existe à l’état naturel mais en quantité trés
faible. Pour en avoir une quantité appréciable, il faut maîtriser les techniques de séparation isotopique: ce fut un des enjeu fondamentaux pendant la dernière guerre mondiale pour préparer l’arme atomique.
La composition isotopique des composants chimiques de l’eau est utilisée dans l’estimation de paramètres thermodynamiques comme la température;
le rapport 18 O/16O de la glace des calottes polaires et de l’eau des nappes fossiles renseigne sur le climat du passé.
L’évaporation de l’eau des océans se fait avec fractionnement isotopique: l’isotope léger de l’oxygène s’évapore de préférence à l’isotope lourd. Les océans sont plus riches en isotopes lourds que l’eau des nuages et des précipitations.
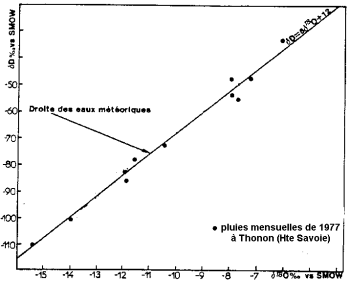
Teneur en isotopes stables des précipitations (d’après Blavoux et Letolle, 1995).
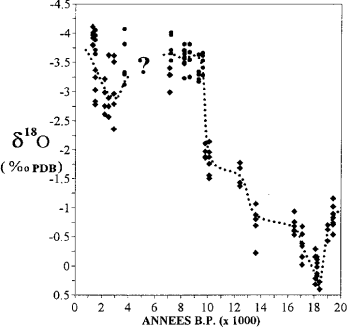
Variation de la teneur en isotopes de l’oxygène dans les coraux de Mayotte (d’après Casanova et al., 1994).
Structure de la molécule
Les atomes d’hydrogène et d’oxygène mettent en commun leurs électrons pour constituer une couche complète comme celle du néon. En effet, il manque 2 électrons à l’atome d’oxygène pour compléter sa couche électronique, ce sont les 2 atomes d’hydrogène qui lui fournissent. La molécule H2O formée est stable.
Oxygène: 8 protons + 8 neutrons
Hydrogène: 2 (2*(1 proton + 1 neutron))
Total: 10 protons équilibrant les charges de 10 électrons.
Les noyaux d’hydrogène se disposent d’un coté de celui d’oxygène pour former une « tête de Mickey » caractéristique (les hydrogènes en étant les oreilles).
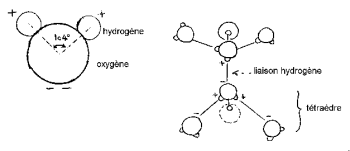
L’angle HOH est de 104,474° (caractéristique de la géométrie tétraédrique). La distance entre atome d’oxygène et d’hydrogène est proche de 1 A° (0,95718 A°) dans la vapeur. Le diamètre effectif de la molécule est de l’ordre de 2,82 A°.
Les charges électriques sont inégalement répartie dans cette petite molécule. Les électrons sont plus fortement attirés vers l’atome d’oxygène que vers celui d’hydrogène. Il se crée 2 centres de charges positives près des noyaux hydrogène et 2 centres de charges négatives près du noyau oxygène. Ce déséquilibre dans la répartition des charges, conjugué avec la géométrie non linéaire de la molécule d’eau, se manifeste par l’existence d’un fort moment dipolaire électrique. La molécule d’eau est polaire; elle se comporte comme un dipôle électrique qui peut ainsi se lier avec d’autres molécules polaires. En effet, les molécules d’eau peuvent s’insérer entre les ions constitutifs d’un cristal en orientant vers eux leur partie de charge électrique opposée. L’attraction des ions cristallins est fortement affaiblie et la cohésion du cristal est diminuée, ce qui facilite sa dissolution. Les propriétés polaires de la molécule d’eau expliquent la technique du chauffage par micro-ondes. En effet une molécule polarisée s’oriente par rapport à un champ électrique; si celui-ci varie, la molécule suit le changement d’orientation . A partir d’une certaine fréquence, quelques GHz pour l’eau, les mouvements des molécules produisent de la chaleur par frottement. Les fours ménagers fonctionnent généralement à une fréquence de 2,45 GHz, ce qui correspond à des ondes décimétriques.
Les 3 noyaux de la molécule ne sont pas immobiles, ils se déplacent les uns par rapport aux autres, la molécule vibre et se tord. Dans l’eau liquide, les molécules ont tendance à s’associer : les têtes de Mickey se lient oreille contre menton par liaison hydrogène. En effet, sur les 8 électrons périphériques de l’oxygène, 4 seulement sont impliquées dans les liaisons covalentes avec les atomes d’hydrogène. Les 4 électrons restants sont groupés en 2 paires appelées doublets électroniques libres. Chacun de ces doublets de charge électrique négative peut former une liaison électrostatique avec un atome d’hydrogène chargé positivement d’une molécule d’eau voisine. La liaison hydrogène, stable à température ambiante, est néanmoins fragile par rapport à la liaison covalente. Dans la molécule d’eau, la géométrie formée par la direction des 2 liaisons covalentes et des 2 doublets électroniques libres est voisine de celle d’un tétraèdre dont le centre est occupé par le noyaux oxygène.
Cependant la structure en grand de la molécule d’eau reste encore imparfaitement connue. Les spectres de diffraction des RX et des neutrons fournissent 2 valeurs principales: un signal correspondant à 1 A°, distance entre les noyaux d’hydrogène et d’oxygène, et une valeur de 2,84 à 4 A° variant selon la température et correspondant à la distance entre 2 noyaux d’oxygène. La diffractométrie RX permet également de connaître le nombre moyen de molécules par unité de volume de liquide situées à une distance R d’une molécule donnée. Une molécule d’eau a en moyenne 4,4 voisines, ce qui suggère une maille tétraédrique. En plus des molécules liées par liaisons hydrogène existeraient d’autres molécules non liées, ce qui peut expliquer que le nombre de molécules voisines soit légérement supérieure à 4, et non 4 exactement comme l’imposerait un strict état cristallisé tétraèdrique. Le réseau cristallin de molécules liées par des liaisons hydrogène constituerait des cavités où se logeraient les molécules non liées. Une autre hypothèse repose sur la distorsion des liaisons hydrogène. Ces dernières, primitivement linéaires, c’est-à-dire avec les atomes O–H-O alignés, pourraient se tordre à des degrés divers et permettre aux molécules plus éloignées que les proches voisines de se rapprocher de la molécule centrale.
Des modèles théoriques ont été élaborés récemment à l’aide d’ordinateurs puissants. Ils indiquent qu’environ 80% des molécules d’eau sont impliquées dans 3 ou 4 liaisons hydrogène; en revanche, ils excluent la présence de molécules non liées. Une modélisation informatique suggère qu’au fur à mesure que l’eau se refroidit, les réseaux de molécules ressemblent de plus en plus à des hexagones similaires à ceux de la glace.
L’état solide correspond à un arrangement cristallin plus strict. A la pression ordinaire, la glace a une structure hexagonale. A basse température (en dessous de -80°C), elle peut prendre une structure cubique. Les charges électriques peuvent se déplacer dans le réseau cristallin et produire des défauts cristallins de type ionique: proton hydraté H3O+ et ion hydroxyle OH-. Le réseau cristallin de la glace ne correspond pas à l’empilement le plus compact possible des molécules. A la fusion, les défauts s’effondrent car les liaisons hydrogène se brisent et les molécules se rapprochent un peu plus: la densité augmente jusqu’à un maximum à 4°C. Par la suite, dans l’eau liquide, l’augmentation de température écarte les molécules et la densité diminue.
En savoir plus, références et bibliographie :
Blavoux B. et Letolle R. (1995) – Apports des techniques isotopiques à la connaissance des eaux souterraines. Géochronique, 54, p. 12-15.
Caro P. (1990) – Les propriétés physiques et chimiques de l’eau. Le grand livre de l’eau, La Villette, p. 183-194.
Eagland D. (1990) – La structure de l’eau. La Recherche, 221, p. 548-552.
Maidment D.R. (1992) – Handbook of hydrogeology. Mc Graw Hill.
Casanova J., Colonna M. et Djerroud K. (1994) – Géoprospective – paléoclimatologie. Rapp. scient. BRGM, p. 76-79.

